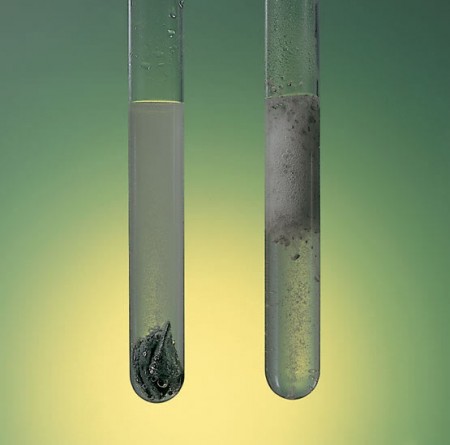
 Käsite reaktionopeus nimeää aineen määrä, joka muuttuu tietyssä reaktiossa tilavuus- ja aikayksikköä kohti. Siten materiaalin, kuten raudan, reaktio on paljon hitaampi ja kestää vuosia verrattuna butaanikaasun palamiseen tulipalon käskystä, joka tapahtuu vain muutamassa sekunnissa.
Käsite reaktionopeus nimeää aineen määrä, joka muuttuu tietyssä reaktiossa tilavuus- ja aikayksikköä kohti. Siten materiaalin, kuten raudan, reaktio on paljon hitaampi ja kestää vuosia verrattuna butaanikaasun palamiseen tulipalon käskystä, joka tapahtuu vain muutamassa sekunnissa.
Sillä välin se tulee olemaan kemiallinen kinetiikka, kyseisellä alueella fysikaalinen kemia se, joka tutkii reaktion nopeutta ja sitä, kuinka tietyt muuttuvat olosuhteet muuttavat materiaalin tai aineen reaktionopeutta, sekä yleisessä reaktiossa tapahtuvia molekyylitapahtumia. Sillä välin se tulee olemaan kemiallinen dynamiikka se, joka käsittelee erityyppisten reaktioiden nopeuksien alkuperän tutkimista.
On huomattava, että kentät, kuten kemiantekniikka, ympäristötekniikka ja entsymologia soveltaa kemiallista kinetiikkaa prosesseissaan.
On olemassa useita tekijöitä, jotka vaikuttavat reaktion nopeuteen ja jotka on tarpeen luetella tietääksesi kuinka ne vaikuttavat siihen ...
Luonto reaktiosta on ratkaiseva, koska jotkut reaktiot voivat luonteensa vuoksi olla nopeampia kuin toiset ja päinvastoin. Reaktiolle altistettujen lajien määrä, hiukkasten fysikaalinen tila ja reaktion monimutkaisuus ovat joitakin tekijöitä, jotka johtavat tässä suhteessa.
Toisaalta, mitä korkeampi keskittyminen sitä nopeampi reaktionopeus.
Paine, vaikuttaa osaltaan myös reaktionopeuteen. Siten kaasumaisten reaktioiden nopeus kasvaa huomattavasti paineen myötä, mikä on käytännössä sama kuin kaasun pitoisuuden lisääminen.
Järjestys Myös reaktion vaikutus vaikuttaa, koska järjestys ohjaa sitä, kuinka konsentraatio vaikuttaa kyseisen reaktion nopeuteen.
Ja lopuksi lämpötila Se on tärkeä, koska suoritettaessa reaktio erittäin korkeassa lämpötilassa se antaa enemmän energiaa järjestelmään ja siksi reaktion nopeus kasvaa aiheuttaen suurempia hiukkasten törmäyksiä.